В электронной версии журнала Nature была опубликована занятная статья, которая по всей видимости дает ответ на биологические механизмы работы метода ДПДГ.
Ниже предлагается мой авторский перевод этого материала.
Биологические доказательства к загадочному лечению травматического стресса
Автор — Эндрю Холмс (Andrew Holmes)
Лечение, называемое десенсибилизацией и переработкой движениями глаз (ДПДГ), облегчает посттравматическое стрессовое расстройство (ПТСР) с помощью загадочных механизмов. Исследование на мышах дает потенциальные ключи к биологической основе этого подхода.
Мы живем в стрессовые времена. Эпидемиологические исследования свидетельствуют о росте распространенности «классических» заболеваний, связанных со стрессом, таких как большая депрессия, посттравматическое стрессовое расстройство (ПТСР) и тревожные расстройства, а также аддикции и другие состояния, которые часто вызываются стрессом.
К счастью, современная неврология придумывает новые стратегии для расшифровки того, как мозг справляется со стрессом. Конечная цель этого — борьба со стрессом, вызывающим болезнь.
В своей статье исследователь Бэк приводит пример силы таких стратегий, используя на мышах комбинацию современных методов нейробиологии и творческого поведенческого анализа.
Переживание медленного нарастания хронического стресса (вызванного, например, повседневной жизнью в зоне боевых действий) принципиально отличается от переживания крупного травматического события (например, наезда на самодельное взрывное устройство). Острые и интенсивные стрессоры могут быть связаны в памяти с определенными стимулами окружающей среды, которые служат напоминанием о первоначальном травматическом эпизоде и предупреждают нас о потенциальных опасностях в будущем. Однако при ПТСР эти стимулы становятся мощными и всепроникающими триггерами тревоги.
В этом и заключается терапевтическая возможность, потому что воздействие напоминаний о травме без причинения вреда (например, в безопасности кабинета терапевта) производит новую форму памяти (называемую памятью исчезновения), которая уменьшает беспокойство.
Этот подход, известный как терапия угасания (extinction therapy), является основой лечения ПТСР, но он работает не у всех пациентов, и его эффекты часто ослабевают с течением времени.
Поэтому предпринимаются значительные усилия по выявлению путей усиления процесса угасания, например путем введения лекарств, способствующих формированию и закреплению угасания памяти о травмирующем событии.
В центре внимания исследования Бэка и коллег находится психологическое лечение, называемое десенсибилизацией и переработкой движений глаз — ДПДГ (EMDR).
В ДПДГ (EMDR) пациент вспоминает травму в процессе того как ему показывают визуальные стимулы для стимуляции повторяющихся движений глаз (процесс, известный как чередующаяся билатеральная стимуляция или ABS).
Несколько крупных организаций психического здоровья выступают за ДПДГ как вариант лечения ПТСР, хотя некоторые исследования показали, что результаты этого лечения не очень отличаются от тех, которые достигаются прямым воздействием напоминаний о травме без одновременной билатеральной стимуляции.
Психологический процесс, посредством которого работает ДПДГ, остается загадочным, а лежащие в его основе нейробиологические механизмы в значительной степени неизвестны.
Бэк и его коллеги для целей исследования использовали мышей, у которых развилось поведение страха (замирание) в ответ на звук, который они ранее слышали, одновременно со звуком получая неприятный электрический удар по ногам (см. рис. 1а).
Затем авторы привели мышей к формированию угасания памяти, представив звук без сопутствующего электрического удара (подход, имитирующий терапию угасания), одновременно подвергая их воздействию набора светоизлучающих диодов (светодиодов), которые загорались в чередующейся последовательности слева-направо и обратно (см. рис. 1б).
Этот подход был предназначен для имитации билатеральной стимуляции, хотя (в отличие от людей, подвергающихся такой стимуляции) трудно точно определить, как мыши направляют свой взгляд и внимание на светодиодные стимулы. Примечательно, однако, что комбинированный подход терапии угасания и билатеральной стимуляцией привел к явному и постоянному снижению поведения страха, которое было более выраженным, чем вызванное терапией угасания или билатеральной стимуляцией по отдельности.
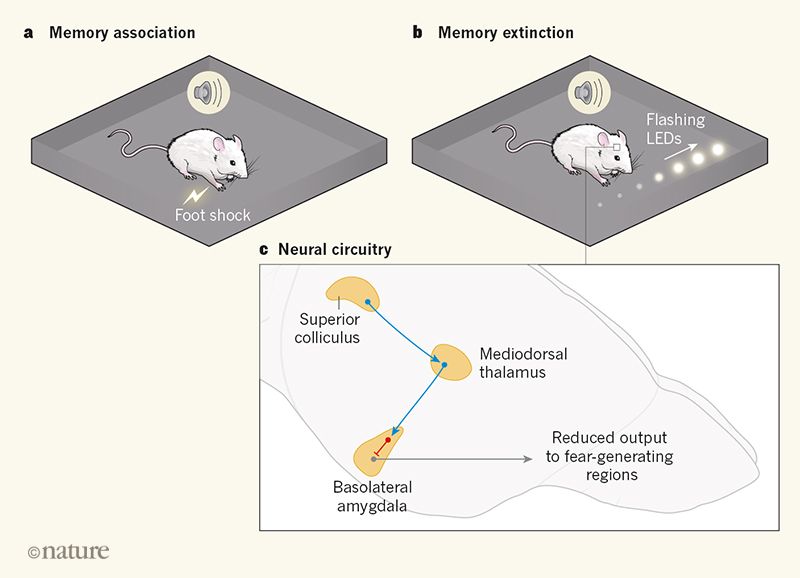
- Мыши уменьшили реакцию страха на звук по сравнению с мышами, подвергшимися воздействию только визуального дисплея или связанного с травмой звука.
- Мыши, подвергшиеся комбинированной световой и звуковой стимуляции, усилили возбуждающие нервные связи (синие стрелки) в головном мозге между верхним колликулусом и медиодорсальным таламусом, а также между медиодорсальным таламусом и базолатеральной миндалиной.
- Это привело к торможению (красная стрелка) нейронов, которые кодируют воспоминания страха в базолатеральной миндалине.
- Это, в свою очередь, уменьшало выход этих нейронов в области мозга, порождающие страх, снижая реакцию страха на напоминание о травме.
Авторы отметили, что комбинированная процедура угасания и билатеральной стимуляции повышала активность верхнего колликула — области мозга, которая обрабатывает зрительную информацию и направляет внимание человека (рис. 1с).
Процедура также активировала медиодорсальный таламус, область, которая получает нейрональные проекции от верхнего колликула. Уровень активации этих двух областей предсказывал степень снижения поведения страха, вызванного комбинированием угасания и билатеральной стимуляции. Когда авторы генетически возмущали нейроны медиодорсального таламуса, чтобы предотвратить их запуск, поведение страха не уменьшалось.
Затем они использовали оптогенетический подход, при котором лазерный свет доставляется по волоконно-оптическому кабелю к нейронам, чтобы заставить замолчать нейрональную сигнализацию между верхним колликулусом и медиодорсальным таламусом. Они обнаружили, что связь между этими двумя областями необходима для снижения поведения страха, вызванного комбинированием угасания и билатеральной стимуляции.
Как усиление связи между областями мозга, более известными своей ролью в сенсорной обработке информации, может привести к снижению поведения страха? Бэком и соавторами наблюдалось, что комбинированная процедура угасания и билатеральной стимуляции ослабляла возбудимость популяции нейронов в базолатеральном ядре миндалины (BLA) — области мозга, которая калибрует реакции страха, которые срабатывали, когда мыши демонстрировали поведение страха.
Затем они показали, что существует функциональная двухэтапная ингибирующая связь между медиодорсальным таламусом и нейронами BLA, кодирующими страх. Когда эти нейроны BLA были оптогенетически заглушены, уменьшающие страх эффекты комбинирования терапии угасания и билатеральной стимуляции были потеряны.
Эти результаты, собранные вместе, предлагают модель, в которой процедуры угасания и билатеральной стимуляции действуют в тандеме, чтобы привлечь нейрональный путь, который связывает верхний колликул и медиодорсальный таламус. Это, в свою очередь, уменьшает реакцию страха на напоминающий травму стимул, который генерируется BLA.
Выводы Бэка и его коллег рисуют всеобъемлющую картину одной из основных нейронных цепей, лежащих в основе эффектов уменьшения страха при сочетании терапии угасания и билатеральной стимуляции, хотя и в упрощенной модельной системе.
Однако ключевые вопросы остаются. Учитывая, что воздействие чередующихся двусторонних зрительных стимулов необходимо для угасания памяти, важно точно выяснить, как мышь, свободно перемещающаяся по тестовой камере, воспринимает эти стимулы.
Будущие исследования могли бы зафиксировать положение головы мыши относительно светодиодов, чтобы гарантировать, что взгляд животного направлен на попеременно мигающие огни.
Более широкий вопрос заключается в том, как билатеральная стимуляция и, соответственно, ДПДГ (EMDR) работают, чтобы помочь угасанию памяти [о травмирующем событии] и уменьшить страх.
Одна из интерпретаций заключается в том, что визуальные стимулы служат в качестве отвлекающих факторов, отвлекая внимание от вызывающего страх стимула, чтобы ослабить тревогу и включить кодирование памяти исчезновения. Но это не объясняет наблюдения авторов о том, что мигание светодиодов в непоследовательном порядке не может уменьшить поведение страха.
Объяснение, основанное на отвлечении внимания, также было бы неуклюжим с той точки зрения, что процесс угасания усиливается за счет направления большего, а не меньшего внимания на вызывающий страх стимул, потому что это повышенное внимание усиливает новую связь между напоминанием о травме и безопасностью.
Бэк и его коллеги предполагают, что билатеральная стимуляция смещает баланс между конкурирующими контурами мозга, задействуя один набор нейронных путей, способствующих исчезновению страха, чтобы затмить влияние других путей, способствующих сохранению страха. Независимо от того, является ли их модель правильной, это исследование обеспечивает правдоподобное нейробиологическое объяснение поведенческих эффектов билатеральной стимуляции — и, возможно, в дальнейшем, ДПДГ (EMDR).
По крайней мере, это дает нам прочную основу для дальнейших исследований этой загадочной поведенческой терапии. Учитывая настоятельную необходимость предоставления людям, страдающим травматическими заболеваниями, целого ряда эффективных методов лечения, это весьма отрадное событие.
Было много споров о том, может ли нынешняя технологически обусловленная революция в нейробиологии помочь начать новую эру в лечении психических заболеваний. Выполнение этого обещания представляет собой огромную проблему, не в последнюю очередь потому, что моделирование психических расстройств и психотерапия, используемая для их лечения в лаборатории, остаются затрудненными.
Ключевые особенности травматического заболевания, такие как приобретенный страх и угасание страха, можно обнаружить даже в простых организмах, что позволяет детально отображать их нейронные основы.
Таким образом, связанные с травмой болезни могут представлять собой прекрасную возможность для терапевтических исследований.
Идеи, такие как те, которые предоставлены Бэком и коллегами предложите дополнительную поддержку в том, что мы скоро увидим некоторые подлинные прорывы в том, как мы диагностируем, лечим и в конечном счете предотвращаем эти разрушительные условия.
Nature, 566, 335-336 (2019)
doi: 10.1038/d41586-019-00294-8
Ссылочный аппарат
- Kessler, R. C. et al. Arch. Gen. Psychiatry 62, 593–602 (2005). — PubMed Article Google Scholar
- Baek, J. et al. Nature 566, 339–343 (2019). — Article Google Scholar
- Foa, E. B. & McLean, C. P. Annu. Rev. Clin. Psychol. 12, 1–28 (2016). — PubMed Article Google Scholar
- Bukalo, O., Pinard, C. R. & Holmes, A. Br. J. Pharmacol. 171, 4690–4718 (2014). — PubMed Article Google Scholar
- Shapiro, F. J. Anxiety Disord. 13, 35–67 (1999). — PubMed Article Google Scholar
- Salkovskis, P. Evidence-Based Mental Health 5, 13 (2002). — PubMed Article Google Scholar
- Tovote, P., Fadok, J. P. & Luthi, A. Nature Rev. Neurosci. 16, 317–331 (2015). — PubMed Article Google Scholar
- Pearce, J. M. & Hall, G. Psychol. Rev. 87, 532–552 (1980). — PubMed Article Google Scholar
- Nestler, E. J. & Hyman, S. E. Nature Neurosci. 13, 1161–1169 (2010). — PubMed Article Google Scholar
- Hariri, A. R. & Holmes, A. Nature Neurosci. 18, 1347–1352 (2015). — PubMed Article Google Scholar